ТЕОРИЯ - ТЕЛОМЕРЫ И ТЕЛОМЕРАЗА
Длина теломер, как маркер возрастных изменений и рисков развития болезней
Клеточный состав организма человека постоянно обновляется. Однако, со временем, клетки утрачивают способность к самовоспроизведению. Это явление получило название "лимит Хейфлика". Для большинства человеческих клеток предел Хейфлика составляет 50-60 делений. Граница Хейфлика связана с сокращением теломер, участков ДНК на концах хромосом. Оказалось, что при каждом делении концевые участки хромосом воспроизводятся не до конца, и новые клетки содержат хромосомы с теломерами меньшей длины.
Укорочение длины теломер с возрастом влияет на функциональную активность клетки, повышает риск развития различных патологий и в конечном итоге, при достижении критической величины, может привести либо к гибели клетки (через процессы самоликвидации – апоптоз) либо к переходу в так называемое, арестованное состояние, с прекращением способности к росту и размножению клетки. . В зависимости от ткани, средняя длина тепломерных участков составляет 10-20 тпн (Gilson E, 2007). Однако, важно не столько среднее значение длины теломер по всем хромосомам, сколько наличие хромосом с критически короткими теломерами (Hemann MT, 2001).
Изменение длины теломер для оценки возрастных изменений
При исследовании теломерных участков хромосом лейкоцитов было показано, что максимальная длина теломер, наблюдается у детей в 18-месячном возрасте (Frenck et al. 1998). Затем в течение первых пяти лет жизни происходит быстрое уменьшение длины теломер (в среднем, до 1.0 т.п.н. в год), предположительно, вследствие высокой скорости пролиферации большинства незрелых клеточных линий-предшественников гематопоэза. В 5-летнем возрасте длина теломер стабилизировалась и поддерживалась на уровне примерно 12 т.п.н. до 25-летнего возраста, после чего наступает неуклонное укорочение теломер по мере увеличения возраста индивида. При этом длина теломер не опускалась ниже критического уровня 5-6 т.п.н. (рис 1).
Изменение длины теломерных участков с возрастом. |
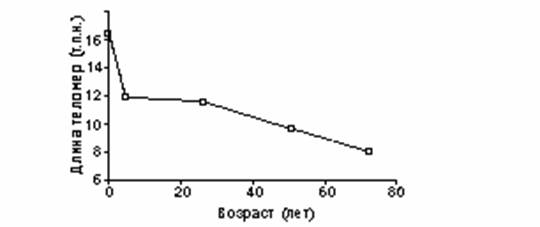
|
В отсутствие патологий и прочих стрессовых воздействий, скорость зависимого от возраста укорочения хромосом является более или менее постоянной величиной (Takubo et al. 2002). Наивысшие скорости укорочения теломер отмечены в лимфоцитах крови, очевидно, по причине высокой скорости оборота (обновляемости) клеток крови (Frenck et al. 1998).
В соответствии с воззрениями геронтологической школы В.М. Дильмана, показатели состояния организма в возрасте 20-25 лет (в этот период заканчивается программа развития организма и человек находится на пике своих физических и психических возможностей) принимаются за точку отсчёта, от которой начинается путь к возрастной патологии. Эти показатели и являются тем идеалом, к сохранению которого необходимо стремиться.
Вместе с тем каждый человек, по существу, уникален, поэтому норма может быть только строго индивидуальна и среднестатистические показатели в практической работе использовать затруднительно. В этой связи оптимальной является норма, свойственная каждому человеку в 20—25 лет. Поэтому важно сопоставлять полученные данные по длине теломер с результатами генотипирования основных полиморфизмов генов, продукты которых участвуют в регуляции активности теломеразы – фермента обеспечивающего восстановление длины теломер.
Обычные соматические клетки организма лишены теломеразной активности. Теломераза экспрессируются в стволовых, половых и некоторых других типах клеток организма, которым необходимо постоянно делиться для функционирования определённых тканей (например, клетки эпителия кишечника). Клетки 85 % раковых опухолей обладают теломеразной активностью, обеспечивая им возможность безлимитного размножения. Katarina Nordfjall с соавторами (2009) исследовали изменение длины теломер клеток крови, полученных от 959 добровольцев с интервалом в 10 лет. Оказалось, что у 1/3 обследуемых длина теломер либо осталась прежней, либо даже увеличилась.
Влияние длины теломер на риски развития заболеваний
Половые различия в длинах теломер
В исследовании M. Kimura, 2007 было показано, что у пожилых женщин средняя длина теломер больше, чем у пожилых мужчин (6.10 и 5.86 kb), и особенно старые женщины имели меньше хромосом с критически короткими участками теломер, чем особенно старые мужчины. Одной из причин такого различия может быть протекторное действие эстрогена, женского полового гормона, о роли которого в регуляции длины теломер можно прочитать в обзоре L. KASZUBOWSKA.
Методы определения длины теломер
Существует несколько подходов к определению длин теломер TRF, Q-PCR, Q-FISH, Flow Q-FISH. Наиболее информативным, способным определять полный спектр длин теломер на концах хромосом, является предложенный в 2003 г. метод, получивший сокращенное название STELA (single telomere elongation length analysis) (Baird et al. 2003). Более простой и часто используемый метод - Q-PCR.
|

