Старение и нейрогуморальный контроль +эндокринная система в целом.
2
Важную роль в развитии старения играет нарушение контроля за функционированием клеток и органов со стороны эндокринной системы. Эти нарушения расценивают как неспособность регулировать гомеостаз организма в ответ на изменения, происходящие как в нём самом и во внешней среде. Формирование фенотипа старения во многом определяется тем, в каком звене эндокринной системы возникают нарушения.
Масса большинства эндокринных органов в процессе старения уменьшается, и в них обычно происходят изменения, приводящие к атрофии и фиброзу. С возрастом проявляется тенденция к образованию аденом в большинстве эндокринных органов, прежде всего в надпочечниках и гипофизе. Уменьшается секреция большинства гормонов. Вместе с тем снижение их клиренса приводит к тому, что концентрация этих гормонов в крови изменяется незначительно или остаётся на прежнем уровне. Снижается активность некоторых клеточных рецепторов, но большинство из них не изменяется. Очень часто в преклонном возрасте уменьшается пост-рецепторная реакция на гормоны, особенно на инсулин, катехоламины, стероидные гормоны и соматомедины. Клинические проявления этих процессов — сахарный диабет, гипотиреоз и снижение усвояемости кальция.
Наиболее типичные эндокринные сдвиги, происходящие при старении, — изменение в функциональном состоянии репродуктивной системы, функции щитовидной и паращитовидных желёз.
РЕПРОДУКТИВНАЯ СИСТЕМА
Включение и выключение половой функции — важнейшие этапы, отражающие существеннейшие моменты программы развития и наступления старения.
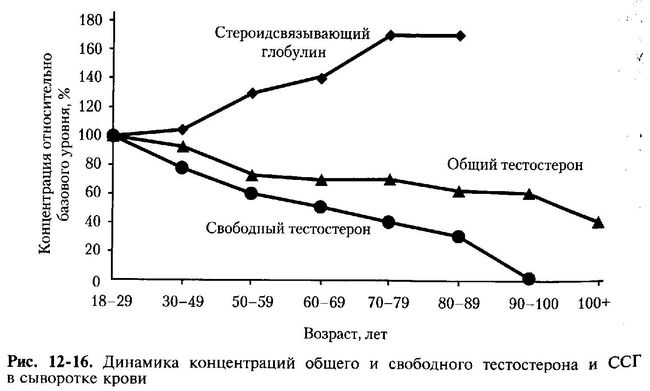
Репродуктивная система мужчин по мере увеличения возраста претерпевает изменения. С 20 до 40-45 лет сколько-нибудь выраженные функциональные и структурные сдвиги отсутствуют. Снижение концентрации тестостерона и повышение концентрации гонадотропинов в крови отмечают у мужчин с 60 лет, и оно сопровождается уменьшением количества клеток Ляйдига (у пожилых мужчин их количество составляет 44% по сравнению с молодыми), продукции спермы и количества нормальных сперматозоидов. Экскреция 17-КС снижается уже с 25-30 лет. У мужчин эти изменения выражены в умеренной степени, и способность к оплодотворению сохраняется. Более чем у 50% мужчин сперма вырабатывается и после 70 лет, а в ряде случаев способность к оплодотворению сохраняется даже в глубокой старости. Тем не менее качество спермы ухудшается. Риск возникновения врождённых дефектов у ребёнка от мужчины старше 40 лет возрастает на 20%. В 70-80 лет содержание тестостерона в крови составляет приблизительно половину от его уровня в 20-50 лет, а в 80-90 лет — немного более трети этого уровня. Происходит и относительное повышение содержания эстрогенов с изменением отношения андрогены/эстрогены.
Учитывая значительные интервалы референтных величин концентрации тестостерона в сыворотке крови большинство исследователей для сравнения используют нормальные оптимальные концентрации гормона для здоровых людей в возрасте 30-35 лет, которые составляют для мужчин 700-900 нг/дл, для женщин — 50-70 нг/дл.
С возрастом концентрация общего и свободного тестостерона в сыворотке крови снижаются, в то время как содержание ССГ увеличивается (рис. 12-16) [Wright J.V., Lenard L., 2000]. ССГ способен связывать 3 молекулы свободного тестостерона и тем самым блокировать его эффекты.
Снижение концентрации тестостерона по мере старения и связаннее! с этим проявления в настоящее время определяют как «мужской Климами! или андропаузу. Андропауза включает следующие проявления.
• Усталость.
• Плохой сон.
• Уменьшение мышечной массы и силы. Снижение концентрации тесстерона в крови прямо коррелирует с уменьшением скорости синтез мышечных белков, формированием сократительных структур и мышечной силы. Уменьшение мышечной массы коррелирует с повышенным риском падений и переломов.
• Увеличение жировой массы, особенно в области живота и на груди иногда гинекомастию. Увеличение жировой массы связано с повышнием концентрации лептина, пептидного гормона жировой клетЧатки. Его уровень в сыворотке крови напрямую коррелирует с жировой массой. Концентрации тестостерона в крови и мышечная масса имеют обратную корреляцию с уровнем лептина.
• Снижение массы и плотности костей. Возраст и связанное с ним уменьшение концентрации тестостерона в крови коррелируют с потерей костной массы. У 30% мужчин в возрасте старше 60 лет развивается остеопороз.
• Снижение либидо.
• Эректильная дисфункция (снижение потенции, уменьшение объёма эякулята и др.).
• Выпадение волос.
• Появление морщин и сухость кожи.
• Снижение памяти.
• Депрессия.
• Снижение жизненной активности, апатия.
Снижение концентрации тестостерона в крови считают фактором риска таких заболеваний, как атеросклероз, ИБС, сахарный диабет, артериальная гипертензия, ожирение. Повышение концентрации глюкозы, ХС, ТГ, факторов свёртывания крови и снижение ингибиторов коагуляции во многом отражают уменьшение продукции тестостерона с возрастом.
Изменения в репродуктивной системе женщин по мере старения более существенны. Наиболее значимые из них следующие.
• Повышение концентрации ФСГ в 10-20 раз, Л Г — в 3 раза (достигает максимума через 1-3 года после наступления менопаузы); в дальней
шем содержание обоих гонадотропинов в крови начинает постепенно, но неуклонно снижаться.
• Концентрация андростендиона в сыворотке крови уменьшается почти в 2 раза (его секреция в постменопаузе осуществляется преимущест венно надпочечниками).
• Концентрация тестостерона после наступления менопаузы снижается, вследствие ослабления периферической конверсии андростендиона.
• Концентрация эстрадиола в крови после наступления менопаузы сни
жается приблизительно до 10-20 пг/мл.
• Соотношение андрогены/эстрогены после наступления менопаузы рез
ко изменяется в сторону андрогенов.
• Наблюдается снижение концентрации ДГЭА и ДГЭАС в крови.
Вследствие недостатка эстрогенов специфическими для данной возрастной группы становятся проблемы, связанные с необходимостью профилактики остеопороза, нарушений липидного обмена.
ЩИТОВИДНАЯ ЖЕЛЕЗА
Атрофия железистой ткани щитовидной железы, её фиброз и формирование узловых образований типичны для старения. Эти процессы обычно начинаются в возрасте после 50 лет и становятся более заметными к 70 годам. Несмотря на фиброзные изменения, уменьшение коллоида и облитерацию фолликулов, заметных изменений в концентрации гормонов щитовидной железы в крови не происходит. Метаболизм Т4 и его клиренс у пожилых людей замедляется, но компенсаторное снижение его секреции позволяет поддерживать обычный уровень гормона в крови. По мере старения замедляется конверсия Т4 в Т3, поэтому концентрация последнего в крови может быть несколько снижена. Концентрация ТТГ в крови увеличивается (особенно у пожилых женщин). Реакция ТТГ на ТРГ у женщин остаётся нормальной, у мужчин снижается. Возможно, эти половые особенности обусловлены тем, что концентрация Т4 в крови у женщин на протяжении всей жизни на 10% выше, чем у мужчин. Концентрация ТСГ у женщин в период постменопаузы снижается, но незначительно. В пожилом возрасте увеличивается частота аутоиммунного тиреоидита, сопровождающегося повышенным уровнем антитиреоидных AT различных классов в крови. В возрасте старше 55 лет гипотиреоз выявляют у 9,5% женщин, гиперти-реоз — у 2,2%.
ПАРАЩИТОВИДНЫЕ ЖЕЛЕЗЫ
ПТГ принадлежит ведущая роль в поддержании гомеостаза в организме. Механизм обратной связи между концентрацией йот ванного кальция в сыворотке крови и секрецией ПТГ по мере старенк нарушается. Однако в старости содержание ПТГ у мужчин и женщин j растает. Это повышение носит вторичный характер (вторичный гиперп тиреоз) и обусловлено снижением абсорбции кальция в кишечнике его резистентности к действию кальцитриола (1,25-гидроксивитамина;
Признаки гиперпаратиреоза отмечают у 1,5% лиц пожилого возрар Приблизительно 50% таких пациентов составляют женщины старше 50, и 35% — старше 65 лет. Заболеваемость женщин вдвое выше, чем чин, и с возрастом увеличивается. Приблизительно в течение 5 лет по выявления ранних признаков гиперпаратиреоза заболевание ничем се клинически не проявляет у 80% пациентов, но в дальнейшем развиваются'! все характерные признаки первичного гиперпаратиреоза.
ГИПОФИЗАРНО-НАДПОЧЕЧНИКОВАЯ СИСТЕМА
Гипофизарно-надпочечниковая система играет важную роль в общей адаптативной реакции организма, в том числе в обеспечении устойчивости к стрессам, поддержании ионного гомеостаза и регуляции иммунной системы.
Существенные возрастные изменения происходят в надпочечниках. Масса этих желёз начинает снижаться с 50 лет. Наиболее заметные изменения отмечают в коре надпочечников, толщина которой уменьшается в 40-50 лет, тогда как в мозговом веществе возрастные изменения менее выражены.
В то же время разные зоны коры надпочечников подвержены возрастным изменениям в неодинаковой степени. В меньшей мере дегенеративные изменения проявляются в пучковой зоне, продуцирующей ГК. Кортизол играет важную роль в процессах адаптации и реакциях стресса. Этот гормон имеет исключительно важное значение в период старения, которое иногда рассматривают как непрерывную адаптацию. По мере старения ткань пучковой зоны даже возрастает в объёме за счёт двух других зон — сетчатой, продуцирующей половые гормоны, и клубочковой, основной гормон которой — альдостерон — регулирует водный и электролитный обмен. Некоторое её ослабление происходит лишь после 60-70 лет, а в 80 лет концентрация ГК в крови составляет приблизительно треть от таковой в среднем возрасте. У лиц 90 лет и старше концентрация кортизола в крови уменьшается в 1,5-2 раза, но одновременно повышается чувствительность клеток и тканей к ГК. Причина данного эффекта неясна. Видимо, у долгожителей система регуляции функций надпочечников работает на протяжении всей жизни на более высоком уровне, чем у остальных людей. Поэтому функциональное состояние коры надпочечников — один из факторов, способствующих долголетию, и хороший маркёр биологического возраста человека. Существует прямая связь между массой надпочечников и продолжительностью жизни.
Функция сетчатой зоны, продуцирующей стероиды, обладающие андро-генной активностью — ДГЭА, ДГЭАС, андростендион (и его 11(3-аналог), тестостерон, снижается довольно рано — в 40-60 лет. Особенно значительное снижение наблюдают у мужчин 50-59 лет, у женщин андрогенная и глюкокортикоидная функции надпочечников поддерживаются на высоком уровне до глубокой старости. В глубокой старости продукция андро-генов существенно снижается — в 3 раза у мужчин и в 2 раза у женщин по сравнению со зрелым возрастом. Лучшими маркёрами снижения анд-рогенной функции надпочечников считают ДГЭА и ДГЭАС, уменьшение концентрации которых в крови возникает рано (после 40 лет у мужчин), а в глубокой старости они практически не вырабатываются.
Секреция АКТГ с возрастом мало меняется, и базальное содержание гормона в крови сохраняется приблизительно на одном уровне. Вместе с тем эффективность гипоталамо-гипофизарного контроля над активностью коры надпочечников при старении снижается.
СОМАТОТРОПНАЯ ФУНКЦИЯ ГИПОФИЗА
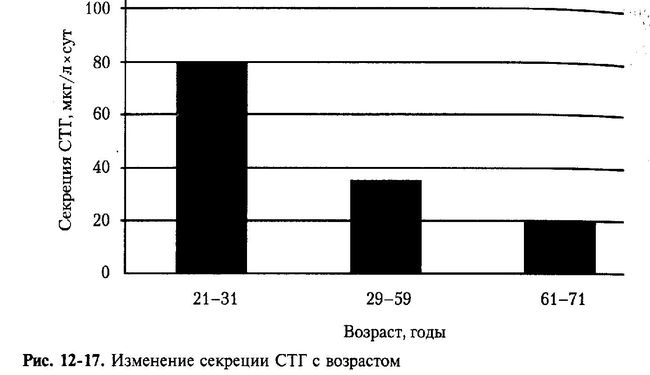
Длительное время считали, что концентрация СТГ по мере старения не изменяется или изменяется незначительно. В настоящее время существуют данные, что к 35-40 годам его содержание в крови уже достигает «старческого» уровня, что составляет приблизительно 50% от пубертатного [Хриса-нова Е.Н., 19991. Если в 20 лет суточная секреция СТГ составляет 500 мкг, а в 40 лет — 200 мкг, то в 80-летнем возрасте она снижается до 25 мкг. Изменение секреции СТГ с возрастом представлено на рис. 12-17 [Klatz R., 1997]. Такие проблемы пожилого возраста, как ожирение, снижение мышечной массы, остеопороз и сахарный диабет во многом связаны с недостаточностью СТГ и его медиаторов.
Причины снижения соматотропной функции гипофиза с возрастом сложны. Исследования показали, что стареющие клетки гипофиза в состоянии секретировать достаточное количество СТГ, если они в полной мере стимулируются. Поэтому возможная причина недостаточности СТГ связана с факторами, которые регулируют его секрецию. Кроме того, по мере старения наблюдается ослабление пострецепторной реакции клеток тканей на гормоны. Особенно выражены эти изменения в отношении инсулина, катехоламинов, стероидных гормонов и соматомединов. Поэтому, возможно, снижается не только количество секретируемого СТГ, но и чувствительность рецепторов тканей к нему и соматомединам. СИМПАТОАДРЕНАЛОВАЯ СИСТЕМА
Симпатоадреналовая система играет незначительную роль в процессах старения, однако она занимает важное место в поддержании гомеостаза и регулировании температуры тела, энергетического обмена и артериального давления. В целом функциональная активность симпатоадреналовой системы по мере старения ослабевает, что сказывается на многих биологических функциях пожилых людей.
Концентрация норадреналина в плазме крови с возрастом увеличивается. У пожилых людей сохраняется циркадный ритм концентрации норадреналина в плазме крови, но различия в этом плане между молодыми и пожилыми становятся особенно наглядными в ночное время. Повышение концентрации норадреналина объясняется нарушением барорецептор-ных рефлексов, сопровождающимся повышением тонуса симпатической нервной системы и изменением реактивности адренорецепторов. При этом реакции, опосредованные р-адренорецепторами (например, частота сердечных сокращений, высвобождение ренина), ослабевают, в то время как ос-адренорецепторы и в старости сохраняют нормальную реактивность, в том числе способность к сокращению сосудов. Снижение вазодилатации, опосредованной р-адренорецепторами, и сохранение способности к сокращению сосудов, регулируемой а-адренорецепторами, при активной секреции катехоламинов могут играть важную роль в развитии артериальной гипертензии у пожилых людей. Ослабление инотропного и хронотропного эффекта со стороны миокарда под влиянием р-адренорецепторов приводит к снижению его функциональных резервов.
1.
Гормоны — физиологически высокоактивные вещества. Они синтезируются в железах внутренней секреции, оказывают, как и нервная система, регуляторное влияние на все важнейшие стороны метаболизма клеток, включая и генетический аппарат, биосинтез белка. Роль гормонов в регуляции деятельности организма так велика, что недостаток или избыток ничтожного их количества может стать причиной грубых нарушений в организме, резких изменений психики, поведения, эмоций, ослабления работоспособности.
В последние годы использование новых методических возможностей и накопление большого фактического материала показало, что бытовавшее ранее представление о возрастном снижении концентрации всех гормонов в крови оказалось неверным. Так, концентрация половых гормонов, гормонов щитовидной железы, некоторых гормонов гипофиза к старости действительно падает, но содержание гормонов коры надпочечников — альдостеро-на, кортизола — не изменяется, а концентрация многих гормонов гипофиза — адренокортикотропного (АКТГ), фолликулостимулирующего (ФСГ), лютеинизирующего (ЛГ) — в старости растет. Каждая клетка находится одновременно под контролем многих гормонов, и характер этого влияния сложно изменяется.
Вместе с неоднозначными изменениями функций желез внутренней секреции в старости происходит и их неодинаковая морфологическая перестройка.
Одни эндокринные железы в старческом возрасте сохраняются относительно неизменными, другие, такие, как щитовидная и паращитовидные железы, существенно перестраиваются. Общей для разных эндокринных желез особенностью является монотонность микроскопического строения в глубокой старости (равно как в период но-ворожденности и в грудном возрасте). В другие возрастные периоды клетки более полиморфны, что отражает разнообразие их морфофункционального состояния.
В корковом веществе надпочечников после 50 лет увеличивается число мелко- и крупноядерных клеток, однако начиная с седьмого десятилетия жизни более частыми становятся клетки с ядрами небольшого размера. Ярких возрастных изменений в коре надпочечников у взрослых людей не обнаруживается: не происходит характерное для старения многих внутренних органов разрастание соединительной ткани, толщина коркового слоя остается относительно неизменной, сохраняется четкая дифференцировка на клубочковую, пучковую и
сетчатую зоны.
Гипофиз в пожилом и старческом возрасте также характеризуется стабильностью структурной организации, определяющей в известной мере и морфологическую устойчивость других эндокринных желез. Однако число дельта-клеток после 60 лет у мужчин больше, чем у
женщин.
Даже вилочковая железа сохраняет до взрослого состояния относительно неизменными ультраструктуры как коркового и мозгового вещества, так и соединительно-тканной стромы. Процессы лимфопоэза в корковом веществе происходят так же, как и в детские годы, а в мозговом веществе создается такое же микроокружение для Т-лимфоцитов, как и в молодом возрасте. В отличие от других желез внутренней секреции, при этом происходит замещение паренхиматозной ткани жировой, но оставшиеся островки паренхимы сохраняют способность к регенерации с образованием железистых структур и телец Гассаля.
В эпифизе при старении обнаруживается лишь полиморфизм и уменьшение размеров ядер пиноцитов, отложение пигмента липофусцина и известковых солей.
В поджелудочной железе в процессе старения наблюдаются морфологические изменения как в экзокринной, так и в эндокринной части. В основе развития возрастных изменений экскреторной части поджелудочной железы лежат общие моменты, свойственные и другим органам. Проявления возрастной инволюции касаются всех элементов протоковой стенки: эпителиальная выстилка их приобретает склонность к пролиферативньм изменениям; происходит метаплазия базальных клеток выводных протоков в плоский эпителий, а также удлинение выводных протоков с их кистозным перерождением; часть коллагена исчезает, вследствие чего происходит нарушение нормального соотношения его с эластической тканью, что приводит к потере эластических свойств стенками протоков и к расширению их просветов. На этом фоне может возникать приспособительное новообразование эластических волокон, что связано с затрудненной эвакуацией секрета и возникающими вследствие этого повторными растяжениями и сжатиями протоков. По мере старения организма может происходить прежде всего гипоплазия (вплоть до полной аплазии) эндокринной ткани. В период от момента рождения до 40—50 лет происходит укрупнение величины долек железы, которое затем сменяется значительным уменьшением их размеров. Поджелудочная железа в пожилом и старческом возрасте становится более плотной за счет склеротических изменений стромы. Эти изменения преобладают в хвостовой части железы, что можно объяснить худшими условиями ее кровоснабжения.
В эндокринной части поджелудочной железы происходят значительные количественные и в меньшей степени качественные изменения, которые претерпевают островки Лангерганса на протяжении всей жизни человека. В таблице 62 приведены данные об изменении количества и диаметров островков Лангерганса у лиц зрелого и старческого возраста.
Таблица 62
Среднее количество и величина островков в поджелудочной железе у лиц различного возраста (Б. А. Кронрод)
Возраст |
Среднее количество островков |
Средний диаметр островков (мкм) |
До 50 лет |
102,9±2,8 |
111,313,7 |
51-60 лет |
125,9±5,2 |
115,813,0 |
61-70 лет |
125,2±4,3 |
121,3+3,2 |
71-80 лет |
129,0±5,9 |
120,8±3,4 |
81-90 лет |
159,1±11,6 |
130,214,9 |
Таблица иллюстрирует значительный рост количества островков и увеличение их диаметра у пожилых людей по мере старения организма. Эти данные никак не помогают раскрыть причины угнетения функциональной активности островков Лангерганса и нарастания количества случаев диабета в старческом возрасте.
Исследование клеточного состава островков у лиц зрелого и старческого возраста показало, что с возрастом происходит изменение в соотношении альфа- и бета-клеток, особенно заметным оно становится начиная с конца шестого десятилетия жизни, в то время как в возрастной группе от 51 до 60 лет соотношение клеток близко к таковому у людей более молодого возраста (табл. 63).
У людей с повышенным содержанием сахара в крови количество альфа-клеток в инсулярном аппарате больше, чем у здоровых людей, в связи с чем можно логически допустить, что снижение толерантности людей старческого возраста к сахарной нагрузке и возрастное изменение клеточного состава в островках Лангерганса также взаимосвязаны.
Таблица 63
Соотношение клеток двух основных типов в островках Лангерганса у людей моложе и старше 60 лет (Б. А. Кронрод)
Возрастные группы |
Содержание клеток (в % от общего числа) |
альфа-клетки |
бета-клетки |
До 60 лет |
19,66 |
80,34 |
61 год и старше |
36,87 |
63,13 |
Своеобразный характер имеют возрастные изменения в половых железах. В яичниках выделяют четыре стадии строения: незрелую (при наличии в корковом слое при-мордиальных и малых зреющих фолликулов), эволютив-ную (при дополнительном наличии зреющих фолликулов и граафовых пузырьков), зрелую (при максимальной насыщенности органа фолликулами) и инволютивную (фолликулы единичны или отсутствуют). Последний вариант строения преобладает в яичниках начиная с 30-39 лет, хотя с равной частотой встречается и зрелый тип
структуры.
Раннее снижение числа клеток Лейдига в яичке еще раз подтверждает особый характер инволютивной перестройки половых желез: среднее содержание этих клеток на один каналец яичка уменьшается от 4,7 в 30—39 лет до 3,4 в 60—69 лет при наибольших различиях между возрастными группами 40—49 и 50—59 лет.
Таким образом, возрастная динамика эндокринных желез позволяет выделить два варианта: сохранение относительной морфологической стабильности во всех возрастах (гипофиз, надпочечник) и прогрессирующую перестройку микроструктур, сопряженную со снижением функциональной активности желез (половые железы, поджелудочная, вилочковая, щитовидная, околощитовидные).
Однако сводить анализ возрастных изменений эндокринных желез только к морфологической характеристике было бы неправомерным. Принципиально
важны системный подход, анализ гормональных механизмов с позиций саморегуляции. Чтобы объяснить возрастные изменения гормональной регуляции, необходимо для каждого из ее типов проследить сдвиги в разных звеньях цепи нейрогуморальной саморегуляции: гипоталамо-гипофизарный контроль железы (образование и выделение гормонов) — транспортные формы гормона в крови — обмен гормона в ткани — реакция тканей на действие гормона (прямая связь) — влияние гормонов на центры (обратная связь) и др.
Сложнейшие взаимоотношения между нервной и эндокринной системами определяются функцией гипоталамуса, его нейросекреторной деятельностью. В составе нейросекрета много посредников, активизирующих или угнетающих гормонообразование в гипофизе. Эти гипо-таламические медиаторы называются рилизинг-фактора-ми (от англ, «releasing» — освобождающий).
Клетки, образующие нейросекрет, в свою очередь находятся под влиянием выделяющихся в окончаниях нейронов медиаторов (посредников) — норадреналина, серотонина, ацетилхолина, у-аминомасляной кислоты и др. Одни из этих медиаторов в большей мере активируют, другие подавляют синтез рилизинг-факторов. Более того, возбуждающие и тормозные влияния могут осуществляться одним и тем же медиатором за счет соединения с различными рецепторами клетки.
При старении неодинаково в разных ядрах гипоталамуса изменяется синтез медиаторов, что изменяет запуск всей нейрогормональной цепи. В ряде ядер существенно падает обмен этих веществ. При старении ослабляется синтез ряда рилизинг-факторов. Вместе с тем секреция многих гипофизарных гормонов растет. Это происходит в результате роста чувствительности секреторных клеток гипофиза к рилизинг-факторам.
Многие гормоны находятся в крови как в свободном, так и в связанном состоянии. При старении снижается доля связанного гормона (щитовидной железы, коры надпочечников), и за счет этого поддерживается достаточный уровень физиологически активной свободной формы. При старении изменяется реакция клеток на действие ряда гормонов.
Возрастные изменения реакции тканей не укладываются в количественные категории «больше-меньше». Часто возникают качественные различия в реакциях. К примеру, половые гормоны, активизируя у молодых и взрослых синтез белка, у старых могут стимулировать распад. Адреналин вызывает у старых животных не рост, а падение тонуса сосудов, и т. д. Тироксин может у старых животных стимулировать синтез белка, а у молодых — распад. Чрезвычайно важно, что дозы гормона, стимулирующие у молодых ту или иную функцию, у старых могут ее подавлять. Таким образом, один из механизмов старения может состоять в активном подавлении гормоном функции той или иной железы, ткани-мишени.
Большую роль в механизме старения играет угасание функции половых желез. Неверно связывать начало старения с развитием климакса. Ведь климактерический период — следствие предшествующего старения. Климакс, потеря репродуктивной способности ограждают будущие поколения от передачи нарушенной генетической информации, накапливающейся в половых клетках с возрастом. В этой сопряженности генетической и гормональной перестройки — важный адаптивный механизм сохранения полноценности вида. Угасание функции половых желез благодаря множеству связей перестраивает весь контур нейрогуморальной регуляции в стареющем организме. Эти сдвиги нередко становятся возрастной предпосылкой развития атеросклероза, артериальной гипертонии, ишемической болезни сердца, опухолей. Кроме того, половые гормоны обладают анаболическим действием, активируют биосинтез белка, и изменение их концентрации в крови существенно влияет на старение
организма.
В старости у мужчин заметно снижается секреция мужского полового гормона — тестостерона. Концентрация женского полового гормона (эстрадиола), количество которого у мужчин невелико, в старости даже возрас тает. У женщин падает содержание в крови эстрадиола и прогестерона. Наряду с этим растет концентрация гона-дотропных гормонов гипофиза (ФСГ и ЛГ).
В механизме старения организма играют роль изменения функций щитовидной железы. Известно, что ее гормоны — тироксин и трийодтиронин — регулируют активность более ста ферментов, влияют на процессы биосинтеза белка и генерации энергии в клетке. При старении снижается активность системы тиреоидной регуляции, и это может стать причиной многообразных сдвигов: падения потребления кислорода, образования богатых энергией соединений, изменения в биосинтезе белка, сдвигов в течении основных процессов в центральной нервной системе, снижения сократительной функции сердца и др. С возрастом наступают неравномерные изменения как на этапе прямой, так и на этапе обратной связи.
Наряду со старением развиваются и процессы вита-укта. Они направлены на сохранение функции щитовидной железы. К ним можно отнести снижение количества связанных и увеличение свободных форм гормона, повышение чувствительности щитовидной железы к ти-реоидному гормону гипофиза, а тканей — к действию гормона щитовидной железы и др. Однако, несмотря на эти проявления витаукта, снижение надежности функции щитовидной железы с возрастом нарастает. В основе этого лежат нарушения обмена веществ и структуры клеток щитовидной железы.
В процессе старения развивается скрытая инсулино-вая недостаточность. Уровень сахара крови у здоровых старых людей существенно не изменяется, однако их толерантность, устойчивость к углеводам падает. При сахарной нагрузке у пожилых и старых людей по сравнению с молодыми концентрация сахара крови становится выше и медленнее возвращается к исходному уровню. Инсулиновая недостаточность нарастает, чаще развивается диабет. В США заболеваемость диабетом у мужчин до 25 лет — 1,1 на 1000 человек населения, у
55-64-летних — 25,2, у 65-74-летних — 37,4. Долгое время считалось, что при старении снижается функция поджелудочной железы и это ведет к недостатку инсулина в крови со всеми последующими нарушениями обмена веществ в организме. Однако работы последних лет показали, что дело обстоит значительно сложнее. Оказалось, что у пожилых людей с пониженной толерантностью к углеводам, то есть у людей, медленнее усваивающих этот углевод, количество инсулина в крови велико, однако он не активен. Частично это связано с тем, что при старении в крови нарастает концентрация веществ, ингибирующих, подавляющих активность свободного инсулина. Комплекс инсулина с этими веществами становится неактивным. Природа веществ, инак-тивирующих свободный инсулин, до конца не изучена. По-видимому, это белки, один из которых — синаль-бумин. Низкая активность инсулина может быть также связана с переходом в кровь проинсулина — предшественника активного гормона. Кроме того, в регуляции углеводного обмена инсулин один противостоит целой группе гормонов (адреналин, глюкагон, глюкокорти-коиды и др.), вызывающих мобилизацию углеводов из тканей и, соответственно, рост уровня сахара в крови. С возрастом соотношение сдвигается в сторону этих конт-ринсулярных факторов.
В старости в клетках поджелудочной железы наступают деструктивные изменения, часть их гибнет. Потенциальные возможности В-клеток поджелудочной железы, где синтезируется инсулин, снижены. Кроме того, при старении ослабевает нервная регуляция поджелудочной железы, снижается активность ферментов, участвующих в медиаторной передаче. Снижение активности инсулина в крови, подстегивая поджелудочную железу, способствует истощению и без того измененных В-клеток. Итак, в старости создается комплекс внепанкреатических и панкреатических предпосылок развития инсулиновой недостаточности, способствующей возникновению диабета. Ситуация усугубляется еще и тем, что при старении сни-
жается реактивность тканей по отношению к действию гормона. Это связано с тем, что с возрастом падает число рецепторов клеток, реагирующих на действие инсулина.
Снижение инсулиновой активности приводит к последовательному нарушению многих видов обмена. Так, снижение активности свободного инсулина затрудняет переход, глюкозы в клетку, ее усвоение, ослабевает синтез гликогена. В связи со сдвигами в углеводном обмене снижается синтез основного источника энергии в клетке — АТФ. Повышение содержания связанной формы инсулина приводит к усилению синтеза жира из углеводов в жировой ткани. И, наконец, нарастающая при старении инсулиновая недостаточность способствует сокращению потенциальных возможностей системы биосинтеза белка.
В механизме осуществления приспособительных реакций организма велика роль коры надпочечников. Исследования Л. В. Магдич свидетельствуют о том, что в старости снижается секреция альдостерона, однако концентрация его в крови остается на прежнем уровне, так как ослабевает распад гормона. Наряду с этим растет чувствительность механизмов секреции гормона к АКТГ, вазопрессину и ионам К+, которые являются физиологическими стимуляторами синтеза альдостерона. Повышается также и чувствительность тканей к гормону. По-видимому, сдвиги в альдостероновой регуляции вносят определенный вклад в развивающиеся при старении нарушения ионного гомеостаза, который, в свою очередь, влияет на все стороны деятельности клеток.
Секреция другого гормона коры надпочечников — кортизола — с возрастом практически не изменяется. Однако за этой неизменностью скрываются сдвиги во всех звеньях системы его регуляции — рост количества АКТГ, стимулирующего синтез гормона, повышение чувствительности железы к ряду регуляторных воздействий.
В старости изменяется также реакция клеток на действие гормонов. В изменении реактивности клетки решающее значение имеют сдвиги в состоянии ее рецепции. Обычно оценивается число рецепторов, то есть пусковых
точек действия в клетке, и их сродство — способность рецептора реагировать с гормоном. Рецепторы могут располагаться на клеточной мембране или внутри клетки. В старости число рецепторов и их свойства изменяются по-разному. Так, например, в сердце число рецепторов к адреналину падает, а сродство повышается. В результате чувствительность сердца к адреналину и норадреналину растет, а реакционная способность, возможная амплитуда реакции падает, так как снижается число адренорецепто-ров. В почках растет число рецепторов к альдостерону, а их сродство к гормону падает. С. А. Танин показал, что рецепторы могут быть, но они как бы «молчат», становятся неактивными. Так, у старых животных отсутствует реакция нервных клеток спинного мозга на половые гормоны. Число рецепторов в клетке — величина не постоянная. В молодом организме при изменении концентрации гормона в крови их синтез может активироваться или подавляться. Одна из причин «косности» реакций клеток в старости — снижение способности регулировать число рецепторов.
|