Система иммуногенеза и её старение
2.
Начало старения иммунной системы относится ко времени полового созревания, когда наступают атрофические процессы в вилочковой железе (тимусе). Именно с тимусом и тимусзависимым комплексом иммунной системы в первую очередь связывают ослабление иммунных функций при старении. Масса тимуса максимальна в 5-15 лет, к 20-30 годам происходит её снижение, которое особенно выражено в 50-90 лет.
Инволюция тимуса сопровождается снижением концентрации его гормонов в крови. Концентрация тимопоэтина начинает снижаться в 30 лет, после 60 лет он практически отсутствует.
Старение иммунной системы можно более точно охарактеризовать как изменения в количестве, распределении и активности в популяциях лимфоцитов, в специфичности AT и в цитокинах. В связи с этим возрастные изменения в иммунной системе — процесс, ведущий к состоянию иммунной дисрегуляции. Помимо связанного с возрастом снижения разнообразия спектра Т-лимфоцитов, происходит изменение баланса в подвидах Т-клеток, что отражает уменьшение образования Т-лимфоцитов в тимусе с возрастом. Для престарелых людей характерно снижение функции Т-лимфоцитов. Отношение Т-лимфоцитов CD4/CD8 с возрастом увеличивается.
Старение оказывает существенное влияние и на развитие В-лимфоцитов. Пре-В-лимфоциты — самая многочисленная линия клеток в красном костном мозге, их количество снижается с возрастом на 60-90%. Дефект, лежащий в основе снижения количества пре-В-лимфоцитов, обусловлен нарушением превращения про-В- в пре-В-лимфоциты. Несмотря на снижение образования В-лимфоцитов в костном мозге, количество В-лимфоцитов в периферической крови с возрастом не изменяется, что обусловлено удлинением жизни В-лимфоцитов и их способностью к самообновлению.
Большинство чужеродных Аг стимулируют СО5-В-лимфоциты, которые в ответ на стимуляцию синтезируют AT. При старении происходит снижение ответа CD5-, но не CD5+ В-лимфоцитов, на чужеродные Аг. Следствием этих возрастных процессов является ряд закономерных изменений. Концентрации циркулирующих естественных AT, например AT к Аг групп крови, начинают снижаться в раннем возрасте, и к 80 годам их уровень составляет 50% и ниже от показателей молодых людей (основная причина трудностей определения группы крови у пожилых людей).
Образование AT у пожилых людей фактически ко всем вакцинам (в том числе против гепатита, гриппа и столбняка) снижено по сравнению с молодыми людьми [Schwab R. et al., 1989]. В то же время выраженность иммунного ответа в виде образования AT к большинству Т-независимых Аг (например, пневмококковый полисахарид) поддерживается на одном уровне в течение всей жизни. Тем не менее продолжительность защитного иммунитета после введения пневмококковой вакцины у пожилых людей меньше, чем у молодых [Shapiro E.D. et al., 1991]. По этой причине пожилые люди старше 65 лет должны подвергаться ревакцинации пневмококковой вакциной каждые 5-8 лет.
Несмотря на то что иммунный ответ в виде образования AT ко всем чужеродным Аг с возрастом снижается, продукция Ig и количество лимфоцитов не изменяются. Более того, концентрация IgG и IgA в сыворотке крови с возрастом увеличивается (IgM и IgD — снижаются). Снижение содержания IgM соответствует снижению AT к Аг группы крови и относительной недостаточности ответа на митогены со стороны Т-лимфоцитов, а увеличение IgG отражает способность иммунной системы поддержи! реактивность к Аг, с которыми организм сталкивался раньше.
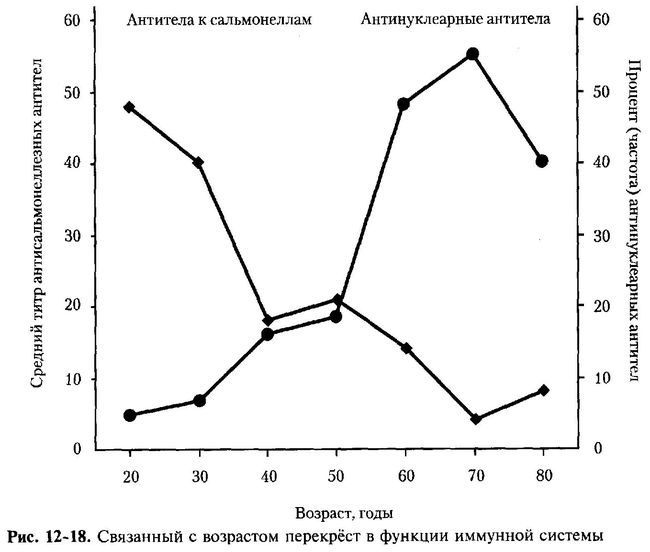
В противоположность снижению продукции большинства AT к чу__ родным Аг, уровень AT синтезируемых CD5+ В-лимфоцитами по ме старения увеличивается. Эти зависимые от возраста изменения в спег„„ фичности Ig, то есть переход от синтеза AT к чужеродным Аг к выработку! AT к аутологичным Аг, представлены на рис. 12-18. При сравнении ср*' держания AT к сальмонеллам и антинуклеарных AT в различные периодц ' жизни человека оказалось, что титр AT к чужеродному Аг (сальмонелле) снижается с возрастом, в то время как количество лиц с антинуклеарным^ AT с возрастом увеличивается [Rowley M.J. et al., 1968].
Несмотря на увеличение образования аутоантител при старении, часто-^ та аутоиммунных заболеваний с возрастом не увеличивается. Аутоиммунные заболевания чаще развиваются в средней трети человеческой жизни. Исключение составляют пернициозная анемия и аутоиммунный тиреои-дит, которые возникают в поздний период жизни.
Вследствие инволюционных процессов в иммунной системе в старческом возрасте повышен риск развития инфекционных, аутоиммунных и злокачественных заболеваний.
1.
Большой теоретический и практический интерес в решении проблемы увеличения средней продолжительности жизни и трудоспособного периода жизни человека представляет изучение связи между иммунитетом и старением, биологическое предназначение которых, по существу, диаметрально противоположно.
Иммунитет на протяжении эволюции из поколения в поколение формировался как система защиты биологической индивидуальности, направленная на создание устойчивости и долговечности живых систем. Процесс старения, напротив, вызывает нарушение целостности и устойчивости организма. Наряду с этим в последние годы развивается также представление, что иммунная система способна выполнять не только защитную, но и патогенную роль в организме, то есть может служить фактором, ускоряющим процесс старения всех других его систем. Уже сегодня нет никаких сомнений в том, что иммунный статус в различные периоды жизни имеет свои определенные особеннос ти, что вызывает необходимость учитывать возраст изучаемых организмов и не ограничивать изучение их иммунного ответа каким-либо одним этапом развития.
Совокупность многочисленных фактов и наблюдений свидетельствует о том, что возрастные изменения иммунологической реактивности, будучи всецело зависимыми от общего старения, в свою очередь, в значительной степени определяют старение других систем организма.
Структура и функции иммунной системы
К числу важнейших положений современной иммунологии относится концепция об иммунологическом надзоре, выдвинутая известным австралийским ученым Ф. Бернетом. Согласно его идее, главная функция системы иммунитета — распознавание «своего» и «чужого». Идея эта расширила границы иммунологии. Если ранее под термином «иммунитет» подразумевали невосприимчивость организма к инфекционным болезням, то теперь его рассматривают как систему защиты организма от всего генетически чужеродного — будь то микробы, чужие клетки, ткани, хирургически пересаженные органы или генетически изменившиеся собственные клетки, включая раковые. Иммунная система распознает чужое, даже если этот носитель чужого отличается всего одним геном. К этому сводится иммунологический надзор.
Говоря об охране биологической индивидуальности, можно считать, что наследственность обеспечивает сохранение индивидуальности от поколения к поколению, а иммунитет — на протяжении жизни каждого
индивидуума.
Основная задача иммунной системы — контроль за генетическим постоянством внутренней среды организма — осуществляется двумя основными способами, первый из которых — гуморальный иммунитет, второй — клеточный иммунитет.
Гуморальный иммунитет осуществляется В-лимфо-цитами, вырабатывающими антитела, а клеточный — Т-лимфоцитами, которые действуют самостоятельно, собс твенными «руками» — рецепторами, находящимися на их поверхности. По своей сути рецепторы — антитела, но представленные не в свободной, а в связанной с лимфоцитами форме. Именно эти рецепторы соединяются с чужеродными клетками и убивают их. Т-лимфоциты этого класса получили название киллеров (убийц). Помимо киллеров, класс Т-лимфоцитов содержит еще 2 подкласса: Т-супрессоры и Т-помощники (хелперы).
Существует еще третий класс клеток иммунной системы — макрофагальный. Макрофаги, или А-клетки, захватывают антиген, перерабатывают его и затем представляют Т- и В-лимфоцитам.
 |
Символ «А» от английского (adherense) — прилепить. Макрофаги хорошо прилипают к поверхности многих материалов, например, стекла, пластика.
Символы «Т» и «В» (от лат. thymus и bursa) введены в иммунологическую литературу в 1969 году. Они представляют собой первые буквы определений «тимусзависимая» и «бурсозависимая» системы лимфоидных клеток.
Родоначальницами Т- и В-лимфоцитов являются так называемые стволовые клетки красного костного мозга. Они активно размножаются, дают начало различным дифференцированным клеткам крови (эритроцитам, лейкоцитам, тромбоцитам) и способны к самовоспроизведению. Их особенностью является способность образовывать кроветворные колонии в селезенке. Коло-ниеобразующая способность стволовых элементов была открыта в 1961 году канадскими учеными Т. Тиллом и Е. Маккуллохом. Стволовые клетки мобильны и постоянно перемещаются по кровотоку. В результате миграции недифференцированные (полипотентные) стволовые клетки, размножающиеся в костном мозге, попадают в различные лимфоидные органы и становятся иммуноком-петентными предшественниками разных типов. Таким образом, стволовые клетки — это своего рода «семенной материал» для всех лимфоидных клеточных популяций, а костный мозг — один из центральных органов иммунной системы, так как он является экспортером стволовых клеток. Клетки, приходящие из костного мозга в тимус, размножаются и превращаются в лимфоциты тимусного происхождения (Т-клетки). Другая часть стволовых клеток костного мозга поступает в сумку Фабрициуса у птиц или ее аналог у млекопитающих и превращаются там в В-клетки. Сумка (бурса) Фабрициуса — своеобразный коллектор лимфоидной ткани. Этот орган располагается у птиц на задней поверхности клоаки. У млекопитающих до сих пор аналог -ее неизвестен, но предполагают, что роль бурсы выполняет красный костный мозг.
Процесс миграции стволовых клеток из костного мозга и их рециркуляция в организме находятся в значительной степени под контролем гипофиз-адреналовой системы. Совсем недавно обнаружено (P.M. Хаитов, 1986), что выключение функции надпочечников (индукция гипокортитизма) посредством их удаления приводит к очень сильному выбросу стволовых клеток из костного мозга в кровь. Напротив, инъекция гормонов коры надпочечников (индукция гиперкортитизма) тормозит процесс миграции стволовых клеток. Очевидно, гормоны коры надпочечников в концентрациях, близких к физиологическим, сдерживают избыточную миграцию стволовых клеток и предохраняют эту популяцию от
«перерасхода».
В иммунной системе «странниками» становятся не только стволовые клетки. Английский ученый Дж. Го-уванс первым доказал, что лимфоциты лимфатических узлов, селезенки и других лимфоидных образований непрерывно мигрируют в лимфу, затем в кровь, оттуда вновь возвращаются в лимфоидные органы.
Способность к рециркуляции — важнейший атрибут лимфоцитов в осуществлении функции иммунологического надзора, так как именно рециркулирующие клетки имеют возможность к контакту с мишенями почти в любых участках организма.
Рециркулирующие лимфоциты можно рассматривать в качестве способа, который выработался в процессе эволюции для защиты от чужеродных элементов из внешнего мира и от вредных мутаций, происходящих в самом организме. Когда циркулирующий лимфоцит встречает чужака (микроб и т. д.), которого он отличает по соответствующей форме (антигенному строению), он либо непосредственно убивает его (функция Т-лимфоцитов-киллеров), либо оказывает разрушающее действие посредством выработки антител (функция В-лимфоцитов). Однако, как оказалось, В-лимфоциты, отличаясь от Т-лимфоцитов по происхождению и функциональным свойствам, не могут работать в одиночку, без Т-лимфоцитов. Чтобы выработать антитела, В-клетки должны вступить в кооперацию с Т-лимфоцита-ми. Вместе Т- и В-клетки образуют иммунокомпетентную единицу. Предполагается, что оптимальная иммуноком-петентная единица создается из одной антиген-активированной Т-клетки и восьми В-клеток.
Это удивительное свойство лимфоцитов взаимодействовать друг с другом открыто в 1968 году Дж. Миллером, а Т-лимфоциты, помогающие В-клеткам синтезировать антитела, получили название Т-помощников.
Весьма поразительным свойством обладает третий подкласс Т-лимфоцитов — Т-супрессоры. Они способны подавлять функцию уже работающих (вырабатывающих антитела) В-клеток по механизму обратной связи. Таким образом, Т-клетки играют регулирующую роль в иммунной системе. Они могут включать и выключать функции других клеток или же работают сами.
Процессы дифференцировок и взаимодействия лимфоцитов, в конечном счете определяющих развитие иммунного ответа, были бы невозможны без способности клеток, составляющих иммунную систему, к миграции.
Иначе говоря, интеграция в иммунной системе обеспечивается процессами клеточной миграции.
Т- или В-лимфоциты могут странствовать в течение нескольких дней или месяцев по всем тканям, органам и жидкостям организма. В отличие от других клеток крови, которые пассивно переносятся с током крови, лимфоциты возвращаются назад в лимфоидные органы удивительным, только им присущим способом — путем проникновения непосредственно сквозь цитоплазму клеток, выстилающих посткапиллярные венулы лимфатических узлов. Такой необычный способ миграции лимфоцитов совершенно не повреждает стенок сосудов.
Скорость рециркуляции лимфоцитов весьма велика. За трое суток происходит полная замена лимфоцитов лимфатического узла за счет миграции из крови и эмиграции по лимфатическим сосудам. Популяция быстро рециркулирующих лимфоцитов содержит главным образом Т-лимфоциты, в то время как большинство медленно мигрирующих клеток относится к В-клеткам.
При попадании антигена в лимфоидные органы Т-клетки концентрируются в повышенных количествах в зоне содержания антигена. Несколько позже в эти области устремляется большее количество В-клеток, где между ними происходит взаимодействие и кооперативное распознавание антигена, приводящее к дифференцировке В-клеток в продуценты антител. Для каждого антигена имеются Т- и В-клетки со своими рецепторами. После запуска и развития иммунного ответа в результате кооперативного взаимодействия Т- и В-клетки вновь выходят из лимфоидных тканей в циркуляцию. Однако это уже качественно иная популяция лимфоцитов. Из стимулированного антигеном лимфоидного органа Т- и В-клетки выходят хорошо знакомыми с данным антигеном, что обеспечивает очень сильный иммунный ответ при повторном попадании этого же (но не другого) антигена (феномен иммунологической памяти).
Таким образом, в процессе иммунного ответа, помимо эффекторных клеток, формируется и популяция так называемых клеток памяти, которые сохраняют и распространяют информацию об антигене по всей иммунной системе. Лимфоциты (носители иммунологической памяти) живут в течение 20 лет и даже больше. Пока в организме нет антигена, вызвавшего их образование, эти лимфоциты инертны и спокойно странствуют по организму. Если антиген попадает в организм повторно, лимфоциты, хранящие информацию о нем, обеспечивают развитие так называемого вторичного иммунного ответа, который вырабатывается намного быстрее и сильнее, чем первичный. Подобно центральной нервной системе, иммунная система обладает способностью к приобретенной памяти, которая не наследуется.
Система иммунологического надзора — не некий уровень защиты вообще. Иммунологическая реактивность всегда конкретна: один и тот же организм может быть сильнореагирующим по отношению к одному антигену и слабореагирующим по отношению к другому. Способность реагировать сильно или слабо на данный антиген передается по наследству в соответствии с законами Менделя.
Тимус
Начиная с 1961 года была установлена выдающаяся роль тимуса в иммунитете и формировании лимфоидной системы.
Тимус, первичный (центральный) лимфоидный орган, располагается в грудной полости непосредственно за грудной костью. В нем содержится огромное количество быстро размножающихся тимических лимфоцитов (тимоцитов). Наибольшего развития тимус достигает к моменту рождения и активнее всего функционирует в первые годы жизни. С возрастом тимус постепенно равномерно атрофируется, но полностью никогда не исчезает. Формирование тимуса заканчивается к 4-му месяцу внутриутробного развития человека. Затем в тимусе не появляются новые структуры, а лишь увеличивается масса органа, которая регламентируется возрастом человека, достигая 30-40 г к периоду полового созревания, то есть к 10—15 годам жизни. Позднее тимус постепенно, но неуклонно уменьшается в массе, достигая 10—13 г к 70—90 годам. Возрастные изменения тимуса происходят параллельно с динамикой общего роста организма. В ходе возрастной инволюции количество лимфоцитов в корковой части долек постепенно уменьшается. Редукция корковой части идет быстрее, чем мозговой. Жировая ткань постепенно замещает функционирующие компоненты тимуса, и к глубокой старости лишь незначительные участки выполняют защитную функцию. Остатки последней со слоистыми эпителиальными тельцами длительно сохраняются даже после почти полного замещения паренхимы железы жировой тканью, разрастающейся со стороны междольковых септ. Таким образом, даже в глубокой старости ткань тимуса полностью не исчезает. От необратимой возрастной инволюции вилочковой железы следует отличать быстрое уменьшение ее размера и веса, наступающее в условиях, когда организм подвергается некоторым вредным воздействиям, например, при интоксикации, инфекциях, голодании, тяжелых травмах. Подобная реакция вилочковой железы носит название акцидентальной инволюции. Это явление временное и обратимое. После прекращения действия неблагоприятных факторов вилочковая железа быстро возвращается к исходному состоянию и восстанавливается в размерах. Удаление тимуса у новорожденных животных предотвращает развитие Т-клеточной системы иммунитета.
Для тимуса характерен поразительно высокий темп размножения лимфоцитов. Несмотря на то что тимус составляет около 10—15% всей лимфоидной ткани, в нем образуется от 50 до 65% всех лимфоцитов, вырабатываемых за сутки. Как и все лимфоидные органы, тимус входит в систему циркуляции. Однако его отличает, помимо других, одна уникальная особенность. Хотя из тимуса постоянно «выселяются» Т-клетки, противотока нет, то есть входные ворота в тимус для лимфоцитов всегда закрыты. Колонизация тимуса — привилегия исключи-
тельно стволовых клеток костно-мозгового происхождения. Полное обновление клеточного населения тимуса за счет прихода стволовых клеток и ухода образовавшихся из них Т-клеток происходит за 4—6 дней. Удивительно также и то, что из тимуса в циркуляцию уходит примерно 5% новообразовавшихся лимфоцитов. Для большинства других клеток, образующихся в тимусе, он же становится могилой — они умирают в нем в течение 3—4 дней. Причина гибели столь большого количества тимоцитов загадочна и до сих пор не расшифрована.
Иммунный ответ при старении
С возрастом иммунологическая реактивность значительно снижается. В условиях старого организма уменьшается количество стволовых элементов в разных кроветворных тканях, интенсивность процессов их миграции, количественные характеристики Т- и В-клеток и макрофагов, гуморального (В-система) и клеточного (Т-система) иммунитета, интенсивность и полноценность кооперативных процессов между клетками.
В кроветворных тканях по мере старения организма происходит постепенное уменьшение числа стволовых клеток. Это явление впервые было обнаружено американским ученым Т. Мейкиноданом и его сотрудниками в 1966 году. При этом значительно снижается и интенсивность миграции кроветворных стволовых клеток.
В процессе старения нарушается также необходимая кооперация Т- и В-клеток при их взаимодействии с антигеном. Взаимодействию Т- и В-лимфоцитов может препятствовать нарушение гуморальных факторов роста, дифференцировки, выживания этих клеток или изменение структуры лимфоидных органов. Возможна комбинация этих двух недостаточностей, что доказано большой серией исследований Мейкинодана с сотрудниками.
Дифференциальный анализ В- и Т-систем иммунитета показал, что снижение иммунного ответа при старении есть результат уменьшения АОК (антитела образующих клеток) и синтеза антител отдельными АОК. Снижение способности синтезировать антитела в старости может быть следствием либо внутренних изменений иммуно-компетентных клеток, либо внешних факторов (смесь стволовых клеток, строма лимфоидных органов и т. д.), не позволяющих иммунокомпетентным клеткам максимально проявлять свою активность. Изучением количественной стороны синтеза антител на пике первичного и вторичного иммунного ответа установлено, что при старении угнетается в основном способность синтезировать IgG-антитела, которые вырабатываются преимущественно при вторичном ответе. На синтез IgM-антител, характерных для первичного ответа, старение влияет в меньшей степени.
При старении происходит уменьшение количества и функциональной активности различных субпопуляций Т-клеток. С возрастом уменьшается количество Т-лимфоцитов в тимусе, лимфатических узлах, селезенке и грудном протоке. Снижается число Т-клеток, обладающих вспомогательной (хелперной) активностью при индукции клеточных иммунных реакций, гуморального иммунитета. Снижается число предшественников кил-лерных Т-лимфоцитов. У стареющих мышей, генетически склонных к аутоиммунным поражениям, наблюдается значительное снижение уровня Т-супрессоров в лимфоидных тканях. В этой связи предполагается, что развитие аутоиммунных процессов связано с дефицитом Т-супрессоров. Активность Т-супрессорных лимфоцитов при старении, как правило, снижается. Именно снижением активности Т-супрессоров объясняют возникновение аутоиммунных болезней у стариков: В-клетки выходят из-под контроля Т-супрессоров и начинают синтезировать антитела против самых разных антигенов, в том числе антигенов собственных клеток и тканей.
В 1976 году Р.В. Петровым и P.M. Хаитовым было установлено, что к супрессорным клеткам относится осрбая субпопуляция В-лимфоцитов. Они обладают свойством угнетать процессы иммуногенеза и деления лимфоидных клеток. Красный костный мозг продуциру-
ет особый медиатор — САП (стимулятор антителопроду-центов), а В-супрессоры вырабатывают медиатор обратного действия, который подавляет образование антител. В-супрессорные лимфоциты угнетают иммунный ответ и деление не только собственных или аллогенных (от других людей), но и ксеногенных (животных других видов) лимфоидных клеток, то есть действие медиатора супрес-сорных В-лимфоцитов не подвержено видовому ограничению. Костно-мозговые супрессоры способны угнетать пролиферацию (деление) лимфоидных опухолевых клеток (миелом). При старении и некоторых заболеваниях, связанных с излишней пролиферативной способностью лимфоидных клеток (аутоиммунные поражения, сходные с системной красной волчанкой), активность В-супрес-соров резко возрастает, в то время как активность Т-суп-рессоров снижается. Следовательно, механизм снижения иммунологической реактивности при старении — комплексный. Активность большинства иммунокомпетент-ных клеток снижается, но отнюдь не всех. В-супрессоры, напротив, усиливают свою активность. Таким образом, для восстановления иммунологической реактивности у стариков необходимо избирательно воздействовать на разные звенья иммунной системы: усиливать ослабевшие и угнетать патологически усиленные.
Возможным путем компенсации сниженной иммунологической реактивности при старении может быть восполнение дефицита Т- и В-лимфоцитов или усиление иммунного ответа посредством интенсификации миграции стволовых элементов и гиперактивации кооперативных процессов.
Установление роли макрофагов (А-система иммунитета) в старении иммунной системы в эксперименте на мышах привело к получению противоположных результатов. Одни исследователи наблюдали снижение фагоцитарной активности, другие показали, что переваривающая способность макрофагов старых мышей не снижена, а общее количество макрофагов у них выше, чем у молодых. Оказалось, что переваривающая способность мак- рофагов связана с лизосомальными ферментами: ка-тепсином-у, В-глюкуронидазой и кислой фосфатазой, активность которых возрастает при старении. Макрофаги старых и молодых животных с одинаковым успехом вызывают первичный и вторичный иммунный ответ. По-видимому, способность макрофагов кооперировать с другими типами клеток с возрастом не изменяется.
Возрастные иммунодефицитные состояния
Группа иммунологов из Австралии во главе с Я. Мак-кей выделила как минимум 6 основных категорий возрастной патологии, в той или иной степени имеющих отношение к нарушению иммунной системы:
- Атеросклероз сосудов с заболеваниями, которые зависят от конкретной его локализации — мозг, сердце и т. д.
- Опухоли, частота которых для большинства типовзависит от продолжительности и степени контакта с темили иным канцерогеном, от активности и чувствитель ности, присущих ткани, на которую действует канцероген, а также, возможно, и от иммунологического надзора.
Часто встречаются так называемые лимфопролиферативные опухоли, поражающие ткани иммунной системы.
- Инфекции, в частности, респираторные, к которым пожилые люди особенно восприимчивы. Помимо острых инфекций обычной вирусной этиологии (например, вызванной вирусом герпеса, гриппа и т. д.) с обострением процесса, у пожилых людей отмечаются и локальные
воспалительные процессы, такие, как конъюнктивит, отит, цистит и т. п. Аутоиммунитет, особенно поражающий при старении некоторые эндокринные и экзокринные ткани.
- Токсическое воздействие окружающей среды, ведущее к разрушению тканей (например, эмфизема у курильщиков).
- Дегенерация и гибель клеток — крайняя степень возрастного повреждения, особенно наглядная на примере нервной ткани, когда она проявляется старческимслабоумием и болезнью Паркинсона.
Согласно современным представлениям, истощение тимуса — одна из главных причин недостаточности иммунитета в старческом возрасте. Наиболее типичным нарушением иммунной системы при старении считается амилоидоз, которым страдает около половины людей старше 70 лет. Скопление белкового вещества амилоида в сердце, легких, селезенке и в других органах ведет к нарушению их функции. Старческие бляшки, образованные амилоидными скоплениями, — наиболее типичные признаки старения.
Люди старческого возраста тяжело переносят инфекционные заболевания, которые у них протекают атипично, затягиваются на длительное время, вызывают различные осложнения, плохо поддаются лечению и часто заканчиваются летальным исходом. Инфекции органов дыхания, в частности, воспаление легких, у стариков принимают нередко тяжелое течение. В период эпидемических вспышек группа лиц старческого возраста причисляется к группе больных с повышенным риском. В этом возрасте в 4—5 раз чаще регистрируется пневмония и туберкулез легких; в 6-7 раз выше смертность от пневмонии у стариков, чем у лиц молодого возраста. Увеличивается заболеваемость и смертность от инфекций с гноеродными свойствами, вызывающими воспалительные процессы в легких, в желчных и мочевыводящих путях и т. д. После оперативных вмешательств у стариков часто нагнаиваются и плохо зарубцовываются раны. Инфекции —наиболее частая и опасная для жизни патология старческого возраста.
Имеется также взаимосвязь между возрастной иммунопатологией и злокачественными новообразованиями. Частота злокачественных опухолей возрастает с 45 до 80 лет с тенденцией к удвоению каждые 9—10 лет. В возрасте после 65 лет значительно увеличиваются случаи рака крови (лимфолейкозы). Рак желудка, легких, предстательной железы и других органов — частая патология старческого возраста. Заболеваемость в старческом возрасте, как правило, связана с недостаточностью тимусзависимого звена иммунной системы, в частности, со снижением скорости размножения Т-лимфоцитов. Высказывается мнение, что активность Т-лимфоцитов является более чувствительным показателем биологического возраста человека, чем хронологического.
По мнению А. А. Богомольца, одна из важнейших особенностей стареющего организма — дефицит его адаптационных возможностей. Иммунная система вместо подвижной, легко и разносторонне реагирующей на стимулы, становится ригидной («жесткой»). В старом организме нарушается микровязкость мембраны иммунокомпетент-ных клеток, что ведет к перемещению в мембране главных распознающих структур лимфоцитов — поверхностных рецепторов. Изменения подвижности основных реагирующих механизмов иммунной системы приводят к нарушению распознавания «своего», к развитию аутоиммунных заболеваний или к неспособности узнавания «чужого», то есть к иммунодефицитному заболеванию. В организме появляется большое число измененных мутировавших клеток и продуцируемых ими молекул, с которыми иммунная система не справляется. В результате не выполняется ее главная функция — поддержание генетического постоянства внутренней среды организма.
В последнее время привлекает внимание исследователей одна популяция клеток иммунной системы — естественные клетки-убийцы, или, как их обозначают, «естественные киллеры». Клетки лишены типичных признаков Т- и В-лимфоцитов. Происхождение их не связано с тимусом. Киллеры зарождаются в костном мозге, широко циркулируют по организму и выполняют функцию иммунологически компетентных клеток первого барьера защиты от опухолевых, пораженных вирусом и других патологических клеток. Активность естественных киллеров снижается с возрастом, и, возможно, развитие определенных форм иммунодефицитных состояний у стариков связано с данным дефектом.
Таким образом, иммунодефицитные состояния в старческом возрасте могут развиваться под влиянием следую щих факторов: инволюции основных компонентов иммунной системы, глубокого дисбаланса иммунорегуляторных механизмов, внутреннего дефекта иммунокомпетентных клеток. Знание этих процессов важно для разработки принципов иммунокоррекции в старческом возрасте.
|